Chúng ta đã biết rằng Hóa học lớp 12 là môn học không dễ dàng cho các học sinh. Vì vậy, tài liệu tổng hợp lý thuyết Hóa học lớp 12 giúp học sinh dễ dàng ôn luyện và nắm vững kiến thức trọng tâm. Điều này sẽ giúp các em đạt điểm cao trong các bài thi môn Hóa lớp 12.
Tổng hợp Lý thuyết Hóa học lớp 12 đầy đủ, chi tiết
Chúng ta có thể tìm thấy rất nhiều tài liệu tổng hợp lý thuyết Hóa học lớp 12 trên thị trường. Tuy nhiên, không phải tài liệu nào cũng đáng tin cậy và hợp lý. Để giúp các bạn lựa chọn tài liệu phù hợp, dưới đây là một số tài liệu chất lượng cao mà các học sinh nên tham khảo:
-
Bộ chuyên đề ĐHSP: Đây là bộ tài liệu phổ biến và được nhiều giáo viên giảng dạy. Bộ sách này cung cấp kiến thức chi tiết và bám sát chương trình học của bộ giáo dục.
-
Bài giảng trực tuyến: Ngoài ra, các bạn cũng có thể tham khảo các bài giảng trực tuyến từ các giáo viên dạy Hóa học. Các bài giảng này thường đi kèm với các tài liệu bổ sung và bài tập thực hành để giúp học sinh nắm vững kiến thức.
-
Cuốn sách giáo trình: Cuốn sách giáo trình được biên soạn bởi các chuyên gia trong lĩnh vực Hóa học cũng là một tài liệu quan trọng mà các bạn có thể tham khảo. Cuốn sách này thường bám sát chương trình học và cung cấp kiến thức chi tiết về các khái niệm và công thức.
Chúng ta có thể tìm mua tài liệu này ở các cửa hàng sách trực tuyến hoặc gian hàng trực tuyến như Shopee. Đây là một cách tiện lợi và dễ dàng để tìm được tài liệu phù hợp cho mình.
Chương 1: Este - Lipit
Lý thuyết Este
I. Cấu tạo, phân loại
- Cấu tạo: Khi thay nhóm -OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm -OR thì được este. Este đơn giản có công thức cấu tạo như sau:
 với R, R’ là gốc hiđrocacbon no, không no hoặc thơm (trừ trường hợp este của axit fomic)
với R, R’ là gốc hiđrocacbon no, không no hoặc thơm (trừ trường hợp este của axit fomic)
Este là dẫn xuất của axit cacboxylic. Một vài dẫn xuất khác của axit cacboxylic có công thức cấu tạo như sau:
- Phân loại: a. Este no, đơn chức: Công thức phân tử: CmH2mO2 hay CnH2n + 1COOCn'H2n' + 1 Với m ≥ 2; m = n + n’ + 1; n ≥ 0, n’ ≥ 1.
b. Este không no, đơn chức: Este đơn chức, mạch hở, không no có 1 nối đôi: CmH2m - 2O2
- Este tạo từ axit không no, ancol no: CnH2n - 1COOCn'H2n' + 1 Với n ≥ 2; n’ ≥ 1; m ≥ 4
- Este tạo từ axit no, ancol không no: CnH2n + 1COOCn'H2n' - 1 Với n ≥ 0; n’ ≥ 2; m ≥ 3 (n = 0 ⇒ HCOOCn'H2n' + 1)
c. Este đa chức
- Tạo bởi axit đơn chức và rượu đa chức có dạng: (RCOO)mR’ (nếu gốc R’ là gốc glixerol thì este có dạng lipit (RCOO)3C3H5 với R là gốc axit béo).
- Tạo bởi axit đa chức và rượu đơn chức có dạng: R(COOR’)n (n ≥ 2; R ≥ 0). +) Tạo bởi axit đa chức R(COOH)n và rượu đa chức R’(OH) có dạng Rm(COO)nmR’n. Nếu m = n thì tạo este vòng có dạng R(COO)nR’.
II. Danh pháp
Tên este = Tên gốc hiđrocacbon R’ + tên anion gốc axit (đuôi at)
- Tên 1 số gốc axit thường gặp: HCOOH: Axit Fomic ⇒ HCOO-: Fomat CH3COOH: Axit Axetic ⇒ CH3COO-: Axetat CH2=CHCOOH: Axit Acrylic ⇒ CH2=CHCOO-: Acrylat C6H5COOH: Axit Benzoic ⇒ C6H5COO-: Benzoat
- Tên gốc R’: CH3-: metyl; C2H5-: etyl; CH2=CH-: Vinyl
Ví dụ 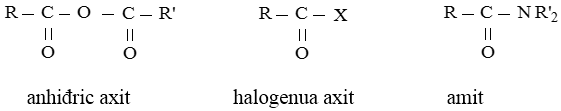
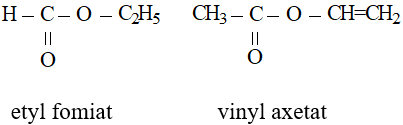
Tính chất vật lý
- Trạng thái: Đa số ở trạng thái lỏng. Những este có KLPT rất lớn có thể ở trạng thái rắn (như mỡ động vật, sáp ong …).
- Nhiệt độ sôi: Thấp, dễ bay hơi do không tạo liên kết hidro giữa các phân tử.
- Tính tan: Ít tan hoặc không tan trong nước do không tạo liên kết hidro giữa các phân tử với nước.
- Đa số các este có mùi thơm đặc trưng:
- isoamyl axetat (CH3COOCH2CH2(CH3)2): mùi thơm của chuối.
- Etyl isovalerat ((CH3)2CHCH2COOC2H5): mùi táo.
- Etyl butirat (CH3CH2CH2COOC4H9): mùi thơm của dứa.
- Geranyl axetat (CH3COOC10H17): mùi hoa hồng …
- Benzyl propionat: CH3CH2COO-CH2C6H5: mùi hoa nhài.
Tính chất hóa học
- Phản ứng ở nhóm chức a. Phản ứng thủy phân Este bị thủy phân cả trong môi trường axit và trong môi trường kiềm. Thủy phân este trong môi trường axit là phản ứng nghịch với phản ứng este hóa:
Ví dụ: Phản ứng thủy phân trong môi trường kiềm là phản ứng một chiều và còn được gọi là phản ứng xà phòng hóa:
Ví dụ: (Chú ý: Nếu este dạng lipit (chất béo) khi xà phòng hóa, ta thu được glixerol C3H5(OH)3 và xà phòng.
Một số phản ứng thuỷ phân đặc biệt của este
Căn cứ vào sản phẩm của phản ứng thủy phân este ta có thể suy đoán cấu tạo của este ban đầu.
Dưới đây là một số trường hợp thuỷ phân đặc biệt của este (không chứa halogen) thường gặp trong bài toán định lượng là:
⇒ X là este của phenol, có công thức là C6H5OOC-R ⇒X là este đơn chức, có công thức là R-COO-CH=CH-R’ ⇒X là este đơn chức, có công thức là R’-COO-C(R)=C(R”)R’’
hoặc “mchất rắn = meste + mNaOH ” hoặc “msản phẩm = meste + mNaOH ”
⇒X là este vòng (được tạo bởi hiđroxi axit, ví dụ:
b. Phản ứng khử Este bị khử bởi liti nhôm hiđrua (LiAlH4), khi đó nhóm RCO- (gọi là nhóm axyl) trở thành ancol bậc I:
- Phản ứng ở gốc hiđrocacbon Este có thể tham gia phản ứng thế, cộng, tách, trùng hợp,... Sau đây chỉ xét phản ứng cộng và phản ứng trùng hợp.
a. Phản ứng cộng vào gốc không no: Gốc hiđrocacbon không no ở este có phản ứng cộng với H2, Br2, Cl2, ... giống hiđrocacbon không no.
Ví dụ: b. Phản ứng trùng hợp: Một số este đơn giản có liên kết C = C tham gia phản ứng trùng hợp giống như anken.
V. Điều chế - ứng dụng
- Điều chế a. Phản ứng giữa axit và rượu
- Từ axit đơn chức và rượu đơn chức:
Ví dụ:
- Từ axit đơn chức và rượu đa chức:
Ví dụ:
- Từ axit đa chức và rượu đơn chức:
Ví dụ:
- Từ axit đa chức và rượu đa chức:
Ví dụ:
b. Phản ứng giữa anhiđric axit và rượu
Ví dụ: Đây là phản ứng để điều chế este của phenol do este của phenol không điều chế được bằng axit cacboxylic.
c. Phản ứng giữa axit và hiđrocacbon chưa no
Ví dụ:
d. Phản ứng giữa muối natri của axit và dẫn xuất halogen
Ví dụ:
- Ứng dụng Este có khả năng hòa tan tốt các chất hữu cơ, kể cả hợp chất cao phân tử, nên được dùng làm dung môi (ví dụ: butyl và amyl axetat được dùng để pha sơn tổng hợp)
Poli (metyl acrylat) và poli (metyl metacrylat) dùng làm thủy tinh hữu cơ. Poli (vinyl axetat) dùng làm chất dẻo, hoặc thủy phân thành poli (vinyl ancol) dùng làm keo dán. Một số este của axit phtalic được dùng làm chất hóa dẻo, làm dược phẩm.
Một số este có mùi thơm của hoa quả được dùng trong công nghiệp thực phẩm (bánh kẹo, nước giải khát) và mĩ phẩm (xà phòng, nước hoa,...).
Nhận biết este
- Este của axit fomic có khả năng tráng gương.
- Các este của ancol không bền bị thủy phân tạo anđehit có khả năng tráng gương.
- Este không no có phản ứng làm mất màu dung dịch Brom.
- Este của glixerol hoặc chất béo khi thủy phân cho sản phẩm hòa tan Cu(OH)2.
Lý thuyết Lipit
I. Khái niệm, phân loại
-
Khái niệm Lipit là những hợp chất hữu cơ có trong tế bào sống, không hòa tan trong nước nhưng tan trong các dung môi hữu cơ không phân cực như: ete, cloroform, xăng dầu.
-
Phân loại
- Lipit bao gồm chất béo, sáp, steroit, photpholipit… hầu hết chúng đều là các este phức tạp.
- Chất béo: là trieste của glixerol với các axit béo, là các axit monocacboxylic có số chẵn nguyên tử C (thường từ 12C đến 24C) không phân nhánh, được gọi chung là triglixerit.
- Sáp: là este của monoancol cao (≥ C16) với axit béo (≥ C16).
- Steroit là este của monoancol mà gốc hidrocacbon gồm 4 vòng có chung cạnh với axit béo.
- Photpholipit là este của glixerol chứa 2 gốc axit béo và 1 gốc photphat hữu cơ.
- Cấu tạo
- Lipit là este của glixerol với các axit béo hay gọi là glixerit.
Hoặc C3H5(OCOR)3 (khi R1 ≡ R2 ≡ R3)
-
Các axit béo trong thành phần chất béo, thường: +) Có mạch cacbon không nhánh. +) Tổng số nguyên tử cacbon là số chẵn (16,18,...).
-
Chất béo chứa các gốc axit béo no (mỡ động vật) thường ở dạng rắn, còn chất béo chứa các gốc axit không no (dầu thực vật) ở dạng lỏng.
-
Chất béo không tan trong nước, nhẹ hơn nước, nhưng tan được trong các dung môi hữu cơ như benzen, rượu,...
-
Chất béo động vật: Glixerit của axit no panmitic, stearic nên ở thể rắn.
-
Chất béo thực vật: Glixerit của axit chưa no oleic nên ở thể lỏng.
-
Một số chất béo thường gặp: +) Axit panmitic: C15H31COOH +) Axit stearic: C17H35COOH +) Axit oleic: C17H33COOH (có 1 nối đôi) +) Axit linoleic: C17H31COOH (2 nối đôi) +) Axit linolenoic: C17H29COOH (3 nối đôi)
II. Tính chất vật lý
- Trạng thái tự nhiên
- Chất béo là thành phần chính của mỡ động vật và dầu thực vật.
- Sáp điển hình là sáp ong.
- Steroit và photpholipit có trong cơ thể sinh vật.
- Tính chất vật lý
- Các triglixerit chứa chủ yếu các gốc axit béo no thường là chất rắn ở nhiệt độ phòng, như mỡ động vật.
- Các triglixerit chứa chủ yếu các gốc axit béo không no thường là chất lỏng ở nhiệt độ phòng và được gọi là dầu, thường có nguồn gốc thực vật hoặc từ động vật máu lạnh như dầu cá…
- Chất béo nhẹ hơn nước và không tan trong nước, tan trong các dung môi hữu cơ không phân cực như benzen, xăng, ete…
III. Tính chất hóa học Chất béo có đầy đủ các tính chất của este.
- Phản ứng thủy phân trong môi trường axit Khi đun nóng với nước có xúc tác axit, chất béo bị thủy phân tạo ra glixerol và các axit béo:
Trong công nghiệp, phản ứng trên được tiến hành trong nồi hấp ở 220oC và 25 atm.
- Phản ứng xà phòng hóa Khi đun nóng với dung dịch kiềm (NaOH hoặc KOH) thì tạo ra glixerol và hỗn hợp muối của các axit béo. Muối natri hoặc kali của các axit béo chính là xà phòng.
Chỉ số xà phòng hóa: là số mg KOH dùng để xà phòng hóa hoàn toàn 1 gam lipit (tức là để trung hòa axit sinh ra từ sự thủy phân 1 gam lipit).
Chỉ số axit: số mg KOH dùng để trung hòa axit tự do có trong 1 mg lipit.
-
Phản ứng hiđro hóa Lipit lỏng có gốc axit là không no, để chuyển thành lipit rắn, ta cho tác dụng với H2 có niken làm xúc tác trong nồi hấp.
-
Phản ứng oxi hóa Nối đôi C = C ở gốc axi không no của chất béo bị oxi hóa chậm bởi oxi không khí tạo thành peoxit, chất này bị phân hủy thành các sản phẩm có mùi khó chịu. Đó là nguyên nhân của hiện tượng dầu mỡ để lâu bị ôi.
IV. Vai trò của chất béo
- Vai trò của chất béo trong cơ thể
- Chất béo là thức ăn quan trọng của con người.
- Trong cơ thể người, chất béo là nguồn cung cấp và dự trữ năng lượng.
- Chất bé còn là nguyên liệu tổng hợp một số chất cần thiết cho cơ thể.
- Đảm bảo sự vận chuyển và hấp thụ các chất hòa tan được trong chất béo.
- Ứng dụng của chất béo trong công nghiệp
- Trong công nghiệp, một lượng lớn chất béo dùng để điều chế xà phòng và glixerol. Một số loại dầu thực vật được sử dụng làm nhiên liệu cho động cơ diesel.
- Chất béo còn được dùng trong sản xuất một số thực phẩm khác như mì sợi, đồ hộp…
- Grixerol được dùng trong sản xuất chất dẻo, mĩ phẩm, thuốc nổ…













